肿瘤微环境(TME)的复杂性是肺腺癌(LUAD)进展的关键因素。
2024年2月8日,复旦大学卢春来、葛棣及西南交通大学李国平共同通讯在Nature Communications 发表题为“UPP1 promotes lung adenocarcinoma progression through the induction of an immunosuppressive microenvironment”的研究论文,为了更深入地了解 LUAD 的分子机制,研究对来自117 个LUAD患者样本的 377574 个细胞进行了整合单细胞RNA测序(scRNA-seq)数据分析。通过将scRNA-seq数据与批量基因表达数据联系起来,研究确定了一组与预后相关的UPP1high肿瘤细胞。这些细胞主要位于肿瘤的侵袭前沿,与TME中的免疫抑制成分显示出更强的关联。
细胞因子阵列分析显示,肿瘤细胞中UPP1的上调导致各种免疫抑制细胞因子的释放增加,其中TGF-β1尤为突出。此外,这种UPP1上调还通过PI3K/AKT/mTOR通路提高 PD-L1的表达,这有助于抑制CD8 +T细胞。通过飞行时间(CyTOF)分析进行流式细胞术提供了UPP1在塑造TME免疫抑制性质中的作用的额外证据。使用患者来源的类器官 (PDO),发现 UPP1high肿瘤对博舒替尼和达沙替尼的敏感性相对增加。总的来说,研究强调了UPP1在肺腺癌中的免疫抑制作用,这些发现可能为肺腺癌的分子特征提供见解,并有助于制定个性化治疗策略。

肺癌仍然是全球癌症相关死亡的主要原因,肺腺癌(LUAD)是其最主要的组织学亚型。尽管LUAD的治疗方法取得了相当大的进展,特别是随着免疫疗法的引入,但对大量患者的预后仍然不太理想。肿瘤微环境(TME)的异质性、获得性耐药性以及患者应答的差异等挑战使治疗环境进一步复杂化。这凸显了对个性化治疗策略和更深入地了解分子机制以改善患者预后的必要性。
LUAD TME是一个复杂而多方面的细胞环境,由多种细胞类型组成,包括肿瘤细胞、免疫细胞(如T细胞、B细胞和巨噬细胞)以及内皮细胞和成纤维细胞。在这种环境中,肿瘤细胞与周围的免疫细胞和基质细胞发生复杂的相互作用。这些细胞间相互作用对肿瘤的发生、发展和最终预后至关重要,形成了抑制对肿瘤的免疫反应的免疫抑制环境。TME内部的这种动态对治疗策略具有深远的影响,强调了解这些相互作用以提高癌症治疗疗效的重要性。
尿苷磷酸化酶 1(UPP1)在尿苷代谢、维持体内平衡和辅助嘧啶挽救中起着至关重要的作用。它将尿苷裂解为尿嘧啶和核糖-1-磷酸(R1P),支持糖酵解,尤其是在营养有限的情况下。在低血糖的肿瘤中,UPP1 利用尿苷中的核糖来维持肿瘤细胞代谢,增强其生长和存活。最近关于UPP1在LUAD中的作用的研究表明,它能够调节肿瘤细胞对糖酵解抑制剂的敏感性,从而驱动糖酵解途径并促进肿瘤生长。有趣的是,证据还表明,抑制UPP1可增强抗肿瘤T细胞的浸润。此外,Wang等人发现了UPP1与TME内免疫检查点之间的密切关联,表明UPP1与TME之间存在潜在联系。然而,UPP1在LUAD TME中的确切作用及其在塑造它方面的潜在影响仍有待阐明。
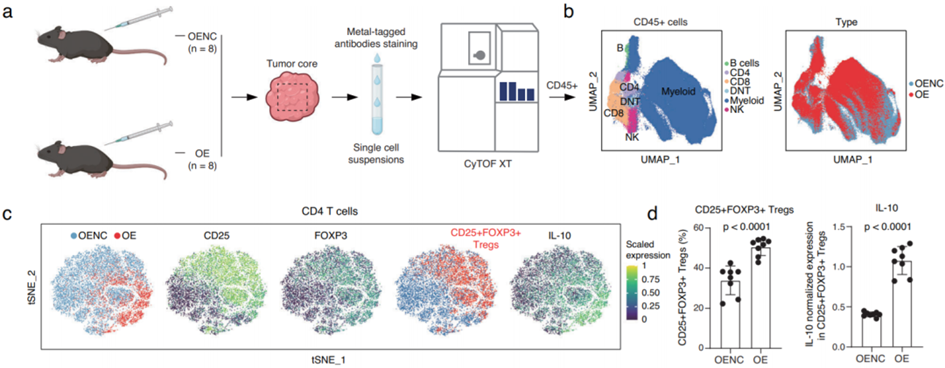
UPP1过表达肿瘤中TME特征变化的CyTOF分析(图源自Nature Communications )
该研究对LUAD进行了整合单细胞RNA测序(scRNA-seq)数据分析,发现了一组与预后相关的UPP1high肿瘤细胞。使用对LUAD患者样本进行多重免疫荧光染色,研究发现 UPP1high肿瘤细胞主要位于肿瘤的侵袭前沿。此外,研究发现肿瘤细胞中UPP1的上调会影响免疫抑制细胞因子的释放和PD-L1的表达。通过飞行时间(CyTOF)分析进行的进一步流式细胞术证实,肿瘤细胞中UPP1的上调有助于免疫抑制性TME的形成。综上所述,这些发现可能为LUAD的分子特征提供更多的见解,并有助于促进个性化治疗策略的制定。
参考消息:https://doi.org/10.1038/s41467-024-45340-w













